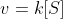Michaelis-Menten-Kinetik von Alpha-Amylase
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
α-Amylasen spalten Amylose (neben Amylopektin einem Bestandteil von Stärke), wodurch unter anderem Maltose entsteht. Durch Nachweis der Stärke mittels Lugol’scher Lösung und Quantifizierung über UV/VIS Spektroskopie lässt sich die Enzymkinetik bestimmen, wodurch die Michaelis-Menten-Parameter bestimmt werden können.
Schwierigkeitsgrad
Schülerexperiment - schwer
Geräte
50 mL Becherglas (2 x), 100 mL Messkolben, Reagenzglas-Ständer, 15 mL Falcon Tubes, Mikroliterpipetten (5000 µL, 1000 µL & 10 µL), Stoppuhr, Magnetrührer mit Heizplatte und Rührfisch, Küvetten (Halbmikro), UV/VIS-Spektrometer, Mikrowelle, Analysenwaage, Computer mit MS Excel (oder anderweitiges Tabellenkalkulationsprogramm)
Chemikalien
lösliche Stärke
α-Amylase aus Bacillus amyloliquefaciens (> 250 U/g)
Lugol’sche Lösung
Durchführung
Zuerst wird eine 1 mg/mL Stärkelösung durch Einwiegen von 100 mg löslicher Stärke und Verdünnen auf 100 mL Wasser hergestellt. Die Stärke muss in der Siedehitze gelöst werden.
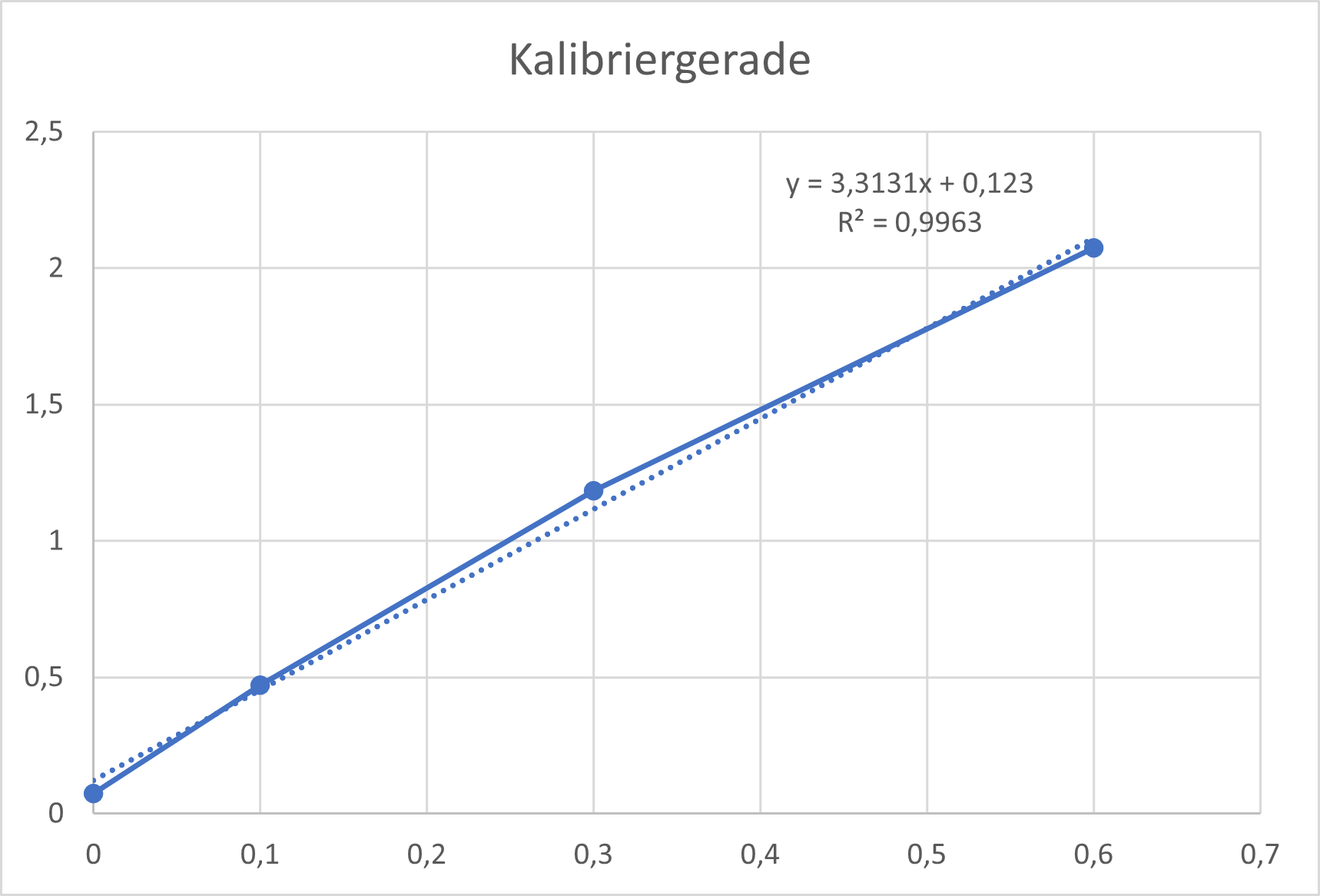
Zur Herstellung der Kalibriergeraden werden von dieser Stärkelösung 0, 100, 300 und 600 µL jeweils mit der entsprechenden Menge Wasser auf 1000 µL verdünnt und zur Gänze in eine Lösung aus 3 mL Wasser und einem Tropfen Iod-Kaliumiodidlösung überführt. Die Absorption bei 600 nm wird daraufhin zügig am UV/VIS-Spektrometer bestimmt.
Zur Reaktion werden 10 mL einer Stärkelösung mit einer Konzentration von 0,5, 0,75 und 1,0 mg/mL zusammen mit 1 µL einer verdünnten Amylase-Lösung angesetzt (10 µL Amylase auf 990 µL dest. Wasser). Nach 1, 3, 5, 10, 15, 30 und 45 min werden 1000 µL als Probe entnommen und wiederum in eine Lösung aus 1 Tropfen Iod-Kaliumiodid-Lösung in 3 mL dest. Wasser überführt. Die Absorption bei 600 nm wird daraufhin zügig am UV/VIS-Spektrometer bestimmt.
| Zeit [min] | Absorption | ||
|---|---|---|---|
| 1,00 mg/mL | 0,75 mg/mL | 0,50 mg/mL | |
| 1 | 2,182 | 1,461 | 1,095 |
| 3 | 1,816 | 1,194 | 0,910 |
| 5 | 1,467 | 0,901 | 0,716 |
| 10 | 1,087 | 0,618 | 0,501 |
| 15 | 0,826 | 0,467 | 0,422 |
| 30 | 0,591 | 0,278 | 0,320 |
| 45 | 0,472 | 0,217 | 0,280 |
Das kann natürlich auch grafisch dargestellt werden:
Zur Datenauswertung werden die Absorptions/Zeit-Verläufe mittels der Kalibriergerade in Konzentrations/Zeit-Verläufe umgerechnet:
| Zeit [min] | Konzentration [mg/mL] | ||
|---|---|---|---|
| 1,00 mg/mL | 0,75 mg/mL | 0,50 mg/mL | |
| 1 | 0,621 | 0,404 | 0,293 |
| 3 | 0,511 | 0,323 | 0,238 |
| 5 | 0,406 | 0,235 | 0,179 |
| 10 | 0,291 | 0,149 | 0,114 |
| 15 | 0,212 | 0,104 | 0,090 |
| 30 | 0,141 | 0,047 | 0,059 |
| 45 | 0,105 | 0,028 | 0,047 |
Danach erfolgt die Bestimmung der Anfangsgeschwindigkeit durch lineare Regression anhand der ersten drei Messpunkte:
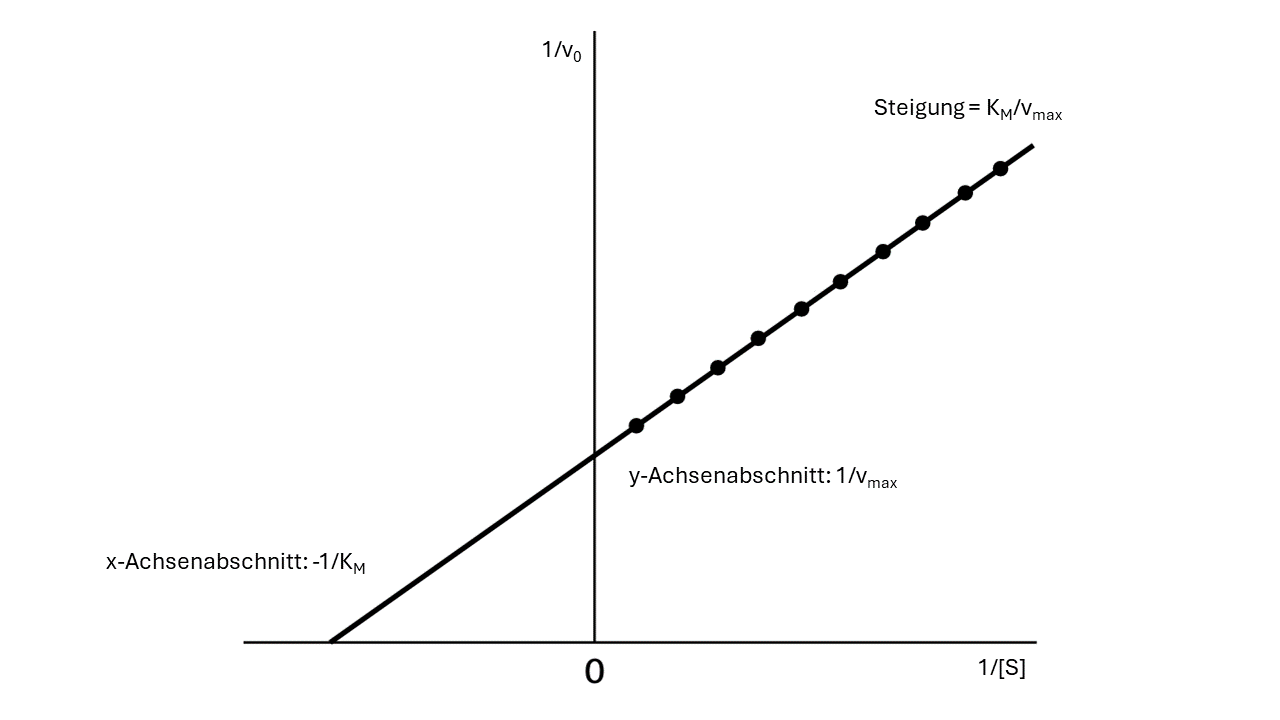
Die reziproken Werte der Anfangsgeschwindigkeit (Geradensteigung) werden mit den reziproken Werten der Anfangssubstratkonzentration in einer Lineweaver-Burk-Darstellung aufgetragen und daraus Vmax und KM bestimmt:
Es konnten 8.62 mg/mL als KM Wert bestimmt werden, bei einer Vmax von 0.52 mg/(mL*min).
Entsorgung
Alle Lösungen, die Iod bzw. Kaliumiodid enthalten, werden als halogenhaltige Salzlösung entsorgt.
Erklärung
Was versteht man unter der “Geschwindigkeit” einer chemischen Reaktion?
Zur Beantwortung dieser Frage wird die folgende Reaktion betrachtet, bei der ein Substrat (S) irreversibel zu einem Produkt (P) umgewandelt wird:
Die Geschwindigkeit der Reaktion würde dann als Änderung der Produktkonzentration (oder negative Änderung der Substratkonzentration) pro Zeiteinheit definiert werden:
Die Reaktionsgeschwindigkeit steht über einen Proportionalitätsfaktor - der Geschwindigkeitskonstante - in Zusammenhang mit der Substratkonzentration:
Hierbei handelt es sich um eine Reaktion 1. Ordnung, da die Geschwindigkeitskonstante in einem linearen Zusammenhang mit der Substratkonzentration steht. Auch andere Reaktionsordnungen sind möglich, beispielsweise ist bei einer Reaktion 0. Ordnung die Geschwindigkeit unabhängig von der Konzentration der Ausgangssubstanz.
Die Reaktionsgeschwindigkeit muss experimentell ermittelt werden, indem im Verlauf der Reaktion die Zunahme des Produkts (oder Abnahme des Edukts) beispielsweise über die Änderung der Absorption gemessen wird. Dabei zeigt sich, dass sich die Konzentration anfangs schnell ändert, sich aber irgendwann einer Gleichgewichtskonzentration annähert - die Reaktionsgeschwindigkeit ist also über den Reaktionsverlauf nicht konstant.
Um dennoch Aussagen über die Kinetik treffen zu können, wird die Anfangsgeschwindigkeit v0 zum Zeitpunkt t ≈ 0 definiert. Da noch kaum Produkt gebildet wurde, ist die Rückreaktion vernachlässigbar klein.
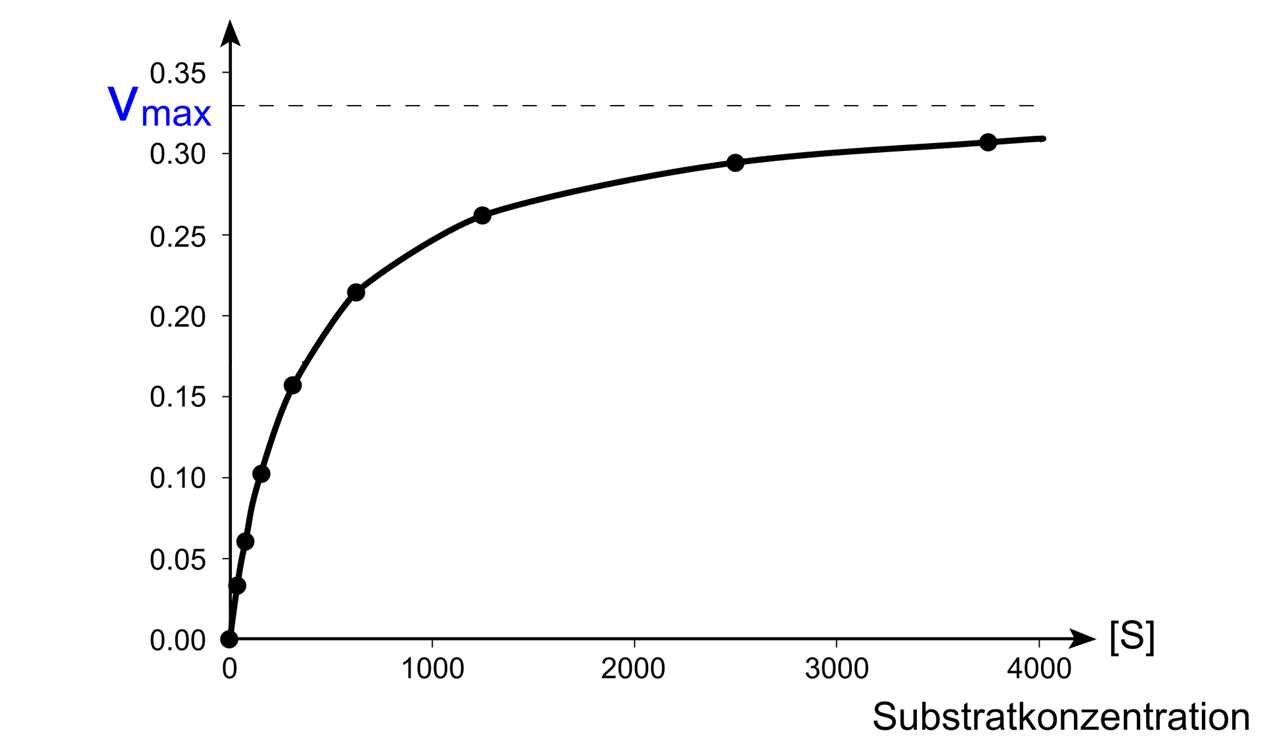
Wird nun die Anfangsgeschwindigkeit von enzymatisch katalysierten Reaktionen bei unterschiedlichen Substratkonzentrationen gemessen, zeigt sich, dass die Anfangsgeschwindigkeit bei steigender Substratkonzentrationen anfangs linear zunimmt, bis sie sich irgendwann einer Maximalgeschwindigkeit vmax annähert:
Zur Beschreibung dieser kinetischen Eigenschaft schlugen Leonor Michealis und Maud Menten 1913 ein einfaches Modell vor. Hierbei formulierten sie einen Enzym-Substrat-Komplex, der als Zwischenprodukt auftreten muss:
Durch drei Annahmen kann das Modell vereinfacht werden:
Die Reaktion wird zum Zeitpunkt t ≈ 0 betrachtet, wodurch noch kein Produkt gebildet wurde und der Enzym-Substrat-Komplex irreversibel zum Produkt zerfällt
Die Konzentration des Enzym-Substrat-Komplexes ist konstant, dessen Bildung und Zerfall also gleich schnell (Steady-State)
Die Konzentration des Substrats ist deutlich höher als jene des Enzyms, die Konzentration an im Enzym gebundenem Substrat ist folglich gegenüber der Gesamtsubstratkonzentration vernachlässigbar.
Dadurch vereinfacht sich die Reaktionsgleichung zu folgendem Ausdruck und die Michealis-Menten-Gleichung lässt sich daraus ableiten (zur exakten Herleitung sei auf einschlägige Literatur verwiesen):
Diese Gleichung beschreibt den zuvor genannten Zusammenhang zwischen v0 und vmax und der Substratkonzentration: Ist die Substratkonzentration kleiner als KM, so steigt v0 linear mit der Substratkonzentration, entsprechend einer Reaktion 1. Ordnung. Ist die Substratkonzentration aber (deutlich) größer als KM, so geht die Reaktion über zu einer 0. Ordnung, bei der v0 gleich vmax entspricht.
Die Michaelis-Menten-Konstante gibt folglich die Substratkonzentration an, bei der die Reaktionsgeschwindigkeit die Hälfte ihres Maximalwertes erreicht. KM ist ein wichtiges Charakteristikum enzymatisch katalysierter Reaktionen und insbesondere für die biologische Funktion der Enzyme von Bedeutung.
Doch wie werden KM und vmax nun bestimmt? Dazu wird die Michaelis-Menten-Gleichung zuerst auf ihre doppelt-reziproke Darstellung umgeformt, wodurch eine Geradengleichung erhalten wird:
Wird nun die experimentell ermittelte rezirpoke Anfangsgeschwindigkeit 1/v0 über die bekannte reziproke Substratkonzentration 1/[S] in einem Lineweaver-Burk-Diagramm aufgetragen, so entspricht die Steigung der Geraden KM/vmax, der x-Achsenabschnitt entspricht -1/KM und der y-Achsenabschnitt entspricht 1/vmax.
Video
Literatur
Cochran et al. "Kinetic Analysis of Amylase Using Quantitative Benedict's and Iodine Starch Reagents" J. Chem. Educ. 85, 3 (2008): 401
Berg, Jeremy M., and John L. Tymoczko. Stryer biochemie. Vol. 8. Heidelberg: Springer Spektrum, 2018.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Lösliche Stärke (kein Gefahrstoff nach GHS)